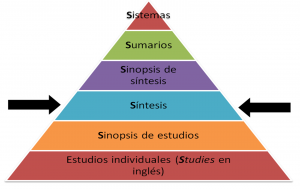
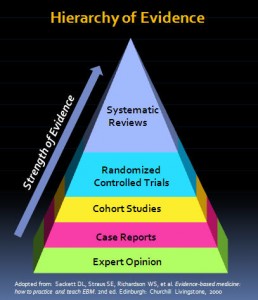
La creación de sumarios de evidencia (o guías de práctica basadas en la evidencia) de novo es una idea muy sugerente, pero también muy time consuming y, en ocasiones, puede ser una duplicación innecesaria de esfuerzos (por no decir una pérdida de tiempo inadmisible; hay mucho trabajo por hacer y muy pocas manos a la obra). Por lo que sabemos (no está escrito en ningún lugar, pero nos lo han contado de primera mano mediante comunicación personal), los expertos a nivel nacional (España) de GuíaSalud (@GuiaSalud) suelen trabajar sobre una guía de unas 15-20 preguntas cerca de 2 años y los expertos internacionales del PEN® demoran unos 3 meses en responder a una sola pregunta.
Si buscamos evidencias con eficiencia siguiendo las recomendaciones de Haynes y cols; 2009, cuando iniciamos un proyecto de creación de un sumarios de evidencia, puede ser una buena idea buscar e incorporar evidencias preevaluadas de otros sumarios o guías de evidencia científica, ya que en ellas se habrá hecho el titánico esfuerzo de buscar de forma sistemática todo el universo de estudios, establecer su calidad y obtener unas recomendaciones fiables. Seleccionar muchas guías distintas podría convertir el afán de ahorro de tiempo en un verdadero infierno (en términos de eficiencia), por lo que se recomienda incorporar solamente las 2 o 3 mejores guías (la cantidad es orientativa, es otra ley no escrita del proceso). En consecuencia, antes de incorporar o usar cualquier guía, deberemos asegurarnos de que éstas son las de más alta calidad.
A continuación, compararemos 2 metodologías de evaluación y adaptación de guías, uno nacional (GuíaSalud; España) y otro internacional (Guidelines International Network [GIN]), resaltando sus puntos fuertes y débiles.
Proceso según GuíaSalud; España
Si consultamos el manual metodológico de los expertos españoles de GuíaSalud, en su Anexo 9 podemos encontrar descrita la metodología usada. En dicho anexo, podemos ver que la adaptación de una guía se puede realizar siguiendo 6 pasos:
Paso 1. Formulación de las preguntas clínicas: bueno, se supone que ya las habremos creado cuando iniciamos nuestro proyecto, aunque no está mal recalcarlo para los más «cagaprisas».
Paso 2. Búsqueda, evaluación de la calidad y selección de GPC: además de explicar dónde suelen buscar las guías (Tripdatabase; ver esta entrada para más información), se indica que para la evaluación de las mismas se recurre al Instrumento AGREE, actualmente llamado AGREE II. Como bien nos cuentan, esta herramienta nos sirve para establecer una puntuación que nos servirá para clasificarlas y decidir qué guía nos conviene más:
- Muy recomendadas: si puntúan 3-4 en la mayoría de los criterios y la puntuación por áreas supera los 60 puntos.
- Recomendada con condiciones o modificaciones: si el número de criterios que puntúan 3-4 es similar al de 1-2 y las puntuaciones por áreas alcanzan valores entre 30-60.
- No recomendadas: si la mayoría de los criterios puntúan 1-2 y las puntuaciones por áreas son inferiores a 30.
En este sentido, para el proceso de adaptación, los expertos de GuíaSalud nos recomiendan seguir los siguientes criterios para seleccionar las mejores guías:
- Que sean guías clasificadas como muy recomendables o recomendadas con modificaciones según la puntuación del instrumento AGREE y con una puntuación superior al 60 en el área de rigor en la elaboración (dominio 3 del instrumento que abarca los ítems del 7 al 14).
- Que las guías estén actualizadas. La fecha de cierre de la búsqueda no debería superar los tres años (excepcionalmente hasta 5).
- Que existan contextos de aplicación similar, es decir, tipos de pacientes, objetivos de la guía, contexto sanitario e inclusive usuarios diana de la guía parecidos.
- Que se puedan obtener las estrategias de búsqueda completas y las tablas de evidencia.
- Otros factores a tener en cuenta: composición del grupo redactor, conflictos de intereses, e impacto de la guía.
Paso 3. Análisis del contenido clínico de la guía por preguntas: se debe valorar cómo la guía responde a cada pregunta formulada en nuestro proyecto.
Paso 4. Aplicación de los criterios de adaptación de guías a las preguntas clave formuladas: se usa una herramienta propia que se basa en preguntas realizadas sobre cada pregunta formulada:
Criterios de adaptación de GPC según GuíaSalud
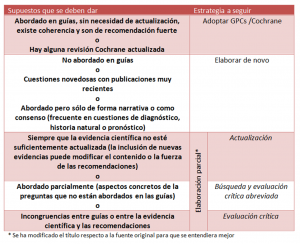
Paso 5. Estrategia a seguir en cada pregunta según diferentes supuestos: de forma muy adecuada, los expertos de GuíaSalud recomiendan seguir diferentes estrategias según diferentes situaciones o supuestos tras aplicar los criterios de adaptación.
Paso 6. Formulación de recomendaciones: se deberá hacer una evaluación formal y juicio razonado, e identificar de forma adecuada qué recomendaciones han sido adaptadas de otras guías, de forma que el usuario pueda identificarlas fácilmente.
Puntos fuertes:
- Es un proceso maravillosamente sencillo.
- Permite una actualización rápida y adaptación si existe algún/os metaanálisis Cochrane reciente/s (<3 años).
- Tiene en cuenta diferentes supuestos en los que nos podemos encontrar al evaluar las guías, proponiendo estrategias concretas de trabajo.
Puntos débiles:
- Describe cómo interpretar las puntuaciones del instrumento AGREE (escala de Likert de 4 puntos) pero no como usar las puntuaciones del instrumento AGREE II (escala de Likert de 7 puntos), para establecer si las guías son muy recomendables, recomendables pero con condiciones, o no recomendables.
- No indica cómo actuar frente a una gran diferencia de puntuaciones de un mismo criterio por parte de diferentes evaluadores. Solamente cómo actuar respecto a la puntuación total del dominio.
- Es posible que se quede pobre en la descripción del significado de: «guía actualizada», «consistencia y coherencia entre guías», y «aplicabilidad de la recomendación en nuestro medio».
- La relación entre los diferentes supuestos al evaluar la guía y la estrategia a seguir respecto a cada pregunta es de difícil visualización.
- Respecto al grado de recomendación, hacen mención expresa al sistema SIGN, actualmente en retroceso respecto al sistema internacional GRADE que está en auge gracias al continuo proceso de evaluación de la metodología.
Proceso según Guidelines International Network (GIN)
La Guidelines International Network (GIN) ha creado un extenso manual de adaptación llamado ADAPTE, manual que los propios expertos de GuíaSalud recomiendan en su portal de herramientas de interés para al adaptación.
En este manual se pueden encontrar, con mucho detalle, 3 fases con 24 pasos (en total; no os asustéis) que el GIN recomienda seguir. Existen muchos pasos compartidos entre los procesos recomendados por GuíaSalud y GIN, siendo el paso 1 de los primeros el paso 7 de los segundos. Sin querer reproducir las 95 páginas que tiene el manual, y abreviando mucho, los pasos recomendados son:
Fase 1, preparación: hay toda una fase de preparación antes de ponerse manos a la obra. Si bien siempre resulta interesante leerse este apartado y seguirlo, muchos de estos pasos ya se habrán llevado a cabo en el proceso de creación del proyecto. Se compone de los pasos 1 a 6.
Fase 2, adaptación: es la parte central del proceso y se compone de los pasos 7 a 18, que vendría a ser la parte descrita por GuíaSalud, sólo que desarrollada con muchos más detalles y en 12 pasos (el doble que GuíaSalud). Sin querer extendernos mucho en nuestra exposición, existen dos cuestiones que creemos importante comentar al respecto:
- Coinciden con GuíaSalud en decir que el dominio «rigor de la elaboración» es especialmente importante.
- Sin embargo clarifican que «una puntuación AGREE pobre no debería ser suficiente para eliminar una guía», sino que deben tenerse en cuenta otros aspectos antes de proceder a la eliminación. A menos que todos los evaluadores consideren que es una guía «no recomendada», se deberá discutir si es pertinente su eliminación o no, inclusive si su puntuación en dominios determinantes como «el rigor de la elaboración» es bajo (interesante punto de vista).
- Añaden que si los mismos criterios son puntuados de forma muy distinta por diferentes evaluadores/as, deben ser identificados como puntos de discusión a solucionar antes de continuar y obtener una puntuación final por dominio (ayuda a solucionar el problema de la variabilidad inter-evaluador).
- Incluyen una serie de herramientas de gran utilidad para recoger más información sobre el estado de actualidad de las guías, la evaluación de la consistencia y coherencia entre guías y la evaluación del grado de aplicabilidad de la recomendación en nuestro medio.
Fase 3, finalización: se ofrece una descripción de cómo terminar el proceso, que se corresponde con la finalización normal del proyecto de elaboración de cualquier guía (revisión interna y externa, etc.). Se compone de los pasos 19 a 24.
Puntos fuertes:
- Tiene en cuenta diferentes supuestos en los que nos podemos encontrar al evaluar una guía.
- Completa un poco el cómo interpretar las puntuaciones del instrumento AGREE.
- Tiene algunas herramientas de interés y muy útiles que permiten matizar el significado de: «guía actualizada», «consistencia y coherencia entre guías» y «aplicabilidad de la recomendación en nuestro medio».
Puntos débiles:
- El sistema es mucho más complejo y largo, sin aportar muchas más ventajas aparentes respecto a la descripción de GuíaSalud (la parte central del proceso de adaptación está bien desarrollado por GuíaSalud).
- Describe cómo interpretar las puntuaciones del instrumento AGREE (escala de Likert de 4 puntos) pero no cómo usar las puntuaciones del instrumento AGREE II (escala de Likert de 7 puntos), para establecer si las guías son muy recomendables, recomendables pero con condiciones, o no recomendables.
- La relación entre los diferentes supuestos al evaluar la guía y la estrategia a seguir respecto a cada pregunta, es de difícil visualización (mucho más que la de GuíaSalud).
En definitiva, para la adaptación de guías basadas en la evidencia tenemos, como mínimo (desconocemos si hay más metodologías), dos metodologías con un mismo corazón y cada una de ellas con sus propios pros y sus contras.
¿Qué metodología elegir? Esta es siempre la cuestión.
Desde luego, si tuviéramos que preparar una guía basada en la evidencia con adaptación incluida, para que fuera evaluada a nivel nacional (España), elegiríamos la metodología de GuíaSalud (que además es menos compleja), pero si tuviéramos que hacerlo para una organización internacional, la metodología de ADAPTE sería la más interesante.
Sin embargo, si tuviéramos que elegir entre una u otra, GuíaSalud es sin lugar a dudas la que tendría más puntos, pero…
¿Y por qué no crear algo intermedio? Uf… que tarde se nos ha hecho, ¡hasta la próxima!