En medicina alternativa y complementaria se usan, muy a menudo, productos o procedimientos dietético-nutricionales que, podríamos decir, se encuentran fuera de las prácticas consideradas como habituales o estándares y desconocemos su eficacia y seguridad.
Las afirmaciones que se hacen de las terapias nutricionales alternativas o complementarias pueden sonar muy prometedoras, sin embargo, la comunidad científica suele desconocer exactamente cuan eficaces y seguras son estas terapias. Queremos dejar claro, antes de seguir, que tal y como detalló el Ministerio de Sanidad, Política Social e Igualdad (MSPSI) en su informe titulado “Terapias naturales”, la nutrición humana y dietética, tal y como se enseña hoy en las universidades, forma parte de la medicina convencional occidental de base científica. En algunas ocasiones, cuando se realizan estudios científicos sobre este tipo de terapias y los resultados no son muy favorecedores, algunos prescriptores y usuarios de las mismas aducen que la ciencia contemporánea no está preparada para evaluar este tipo de terapias, y que las pruebas científicas a las que se están sometiendo dichas terapias no son «justas» o no pueden evaluar los efectos de las mismas. En la misma línea, cuando se pretende evaluar la evidencia científica en torno a este tipo de terapias, sus defensores (y en ocasiones sus usuarios) suelen aducir, además, que las bases de datos biomédicas no albergan estudios de terapias alternativas y que, por lo tanto, la evaluación de las pruebas es parcial y no incluye todos los estudios realizados.
Para responder a algunas de dichas incógnitas, el equipo de Evidencia en Nutrición ha realizado una  mini-entrevista de tres preguntas al profesor Edzard Ernst (@EdzardErnst). Tanto para aquellos que hayan leído algunos o varios de sus textos o artículos científicos, como para aquellos que no lo hayan leído nunca y empiecen hoy, puede sorprenderles saber que el doctor Edzard Ernst sea, a la vez, profesor de medicina complementaria y una de las mentes más críticas y escépticas de este sector, habiendo publicado más de 1.000 artículos en revistas médicas, 48 libros y un sinfín de abrumadores pero a la vez rigurosos posts que critican a menudo el sector de la llamada “medicina complementaria”. Cabe destacar que Edzard Ernst es médico y recibió formación específica en acupuntura, entrenamiento autógeno, herbo-dietética, homeopatía, masaje terapéutico y manipulación espinal. En 1993 fue nombrado Profesor Emérito de la Universidad de Exeter (Reino Unido) donde enseña actualmente medicina complementaria. Asimismo, es editor jefe de dos revistas médicas: Perfusion y Focus on Alternative and Complementary Therapies.
mini-entrevista de tres preguntas al profesor Edzard Ernst (@EdzardErnst). Tanto para aquellos que hayan leído algunos o varios de sus textos o artículos científicos, como para aquellos que no lo hayan leído nunca y empiecen hoy, puede sorprenderles saber que el doctor Edzard Ernst sea, a la vez, profesor de medicina complementaria y una de las mentes más críticas y escépticas de este sector, habiendo publicado más de 1.000 artículos en revistas médicas, 48 libros y un sinfín de abrumadores pero a la vez rigurosos posts que critican a menudo el sector de la llamada “medicina complementaria”. Cabe destacar que Edzard Ernst es médico y recibió formación específica en acupuntura, entrenamiento autógeno, herbo-dietética, homeopatía, masaje terapéutico y manipulación espinal. En 1993 fue nombrado Profesor Emérito de la Universidad de Exeter (Reino Unido) donde enseña actualmente medicina complementaria. Asimismo, es editor jefe de dos revistas médicas: Perfusion y Focus on Alternative and Complementary Therapies.
Como se puede comprobar, no ha sido fruto de la casualidad haber entrevistado a este profesional y no a otro en la materia que nos ocupa. Sin más dilación, veamos lo que responde el profesor Ernst a nuestras preguntas:
Pregunta 1- ¿Cuál es la diferencia (si es que la hay) entre terapia complementaria y alternativa?
Edzard Ernst – La terapia complementaria se define por el uso de dicha terapia como complemento de la medicina convencional, mientras que la medicina alternativa usa dicha terapia como reemplazo de la medicina convencional. Sin embargo, es importante darse cuenta de que una estas modalidades terapéuticas puede ser usada a veces como medicina alternativa, y otras como complementaria. Esta es la razón por la que se usa el término conjunto CAM (Complementary and Alternative Medicine).
Pregunta 2- ¿Es posible evaluar las terapias complementarias y alternativas mediante la ciencia? ¿Se está haciendo actualmente?
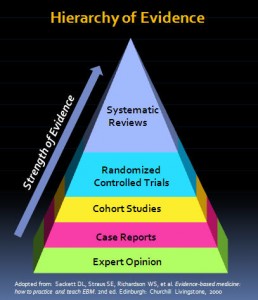
Edzard Ernst – las CAMs pueden y deben ser probadas como cualquier otro tratamiento. Es verdad que esto puede plantear algunos problemas de diseño y ejecución, por ejemplo cuando no haya un placebo obvio. Sin embargo, siempre es posible realizar ECAs (Estudios Controlados Aleatorizados), y a menudo es deseable poner a prueba los muchos reclamos o declaraciones que se hacen de las CAMs.
Pregunta 3- Si se pidiera a algunos científicos que evaluaran toda la evidencia científica sobre las terapias complementarias y alternativas, ¿qué bases de datos cree usted que deberían ser consultadas para garantizar que todos o casi todos los artículos publicados se recuperan y evalúan?
Edzard Ernst – Desde luego sería un error asumir que una sola base de datos puede ser suficiente. Dependiendo del área temática tratada, uno necesitaría no sólo las bases de datos estándar como Medline o Embase, sino también la búsqueda en bases de datos especializadas. Asimismo, es necesario también considerar idiomas distintos al inglés, como por ejemplo, cuando se evalúan medicina tradicional china.
Pese a las pocas preguntas que hemos podido realizar al Prof. Edzard Ernst, creemos poder sacar algunas conclusiones que pueden ser de mucho interés para los lectores de Evidencia en Nutrición y para la obtención de evidencias que evalúen las terapias nutricionales complementarias y alternativas (quede claro que es nuestra propia interpretación sobre la entrevista):
1. Existe una diferencia significativa entre terapia complementaria y alternativa. En la misma línea que el National Center for Complementary and Integrative Health dependiente del gobierno del Reino Unido, Edzard Ernst nos explica que mientras unas se usan como complemento de la terapia convencional, las otras se promueven como alternativa a (en lugar de) ésta. Este es un hecho mucho más significativo de lo que puede parecer, sobre todo cuando nos ponemos en el supuesto menos halagüeño y optimista. Cuando se usa una terapia de eficacia no probada (inclusive de terapias convencionales o estándares) como complemento de otra clínicamente probada, los riesgos asumidos se reducen a posibles efectos adversos no conocidos (que pueden ser severos o leves) o interacciones entre terapias. Sin embargo, cuando se utiliza una terapia no probada en lugar o como sustituto de una terapia clínicamente probada, los riesgos asumidos son exponencialmente más altos, ya que se está evitando que el paciente inicie una terapia testada que le puede curar, para instaurar una terapia de eficacia incierta, lo que puede traducirse en un empeoramiento del pronóstico del paciente (en el peor de los casos) o una disminución de su calidad de vida y vida útil (en los casos más leves). Finalmente, Edzard Ernst nos advierte que una misma modalidad terapéutica se puede usar a veces como complementaria y otras como alternativa, lo que nos lleva a pensar que todas las terapias complementarias y alternativas (inclusive las cercanas a la nutrición humana y dietética), deberían ser adecuadamente testadas a nivel clínico antes de su comercialización.
2. Respecto a si la ciencia contemporánea, incluyendo tanto la investigación primaria (estudios de intervención u observacionales) como la investigación secundaria (metaanálisis y sumarios de evidencia), puede o no evaluar la eficacia de las terapias complementarias y alternativas, Edzard Ernst no deja lugar a debate: todas estas terapias pueden y deben ser probadas como cualquier otro tratamiento. Además, al parecer, y aunque a veces puedan existir ciertas dificultades a la hora de establecer un placebo adecuado, los ECA y los metaanálisis de ECA seguirían siendo los niveles de evidencia más altos. Esto nos hace recordar una frase que compartió el doctor Ernst en su blog, en octubre de 2013: “El plural de anécdota es anécdotas, no evidencia”. Para aquell@s que quieran saber más sobre cómo se prueban los tratamientos, les recomendamos la lectura Cómo se prueban los taratmientos: una mejor investigación para una mejor atención de salud.
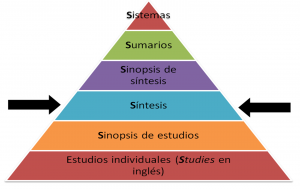
3. Para evaluar todas las evidencias científicas sobre las terapias nutricionales complementarias y alternativas, se deberían evaluar, además de las bases de datos estándares (Medline y Embase), bases de datos especializadas según el área temática. Desde el desconocimiento de los autores de este post sobre este tipo de terapias y sobre las bases de datos que pueden contener estudios científicos sobre éstas, entendemos que deberían revisarse bases de datos similares a la conocida Natural Medicines Comprehensive Database para obtener con más probabilidad todo el universo de publicaciones sobre este tema. Asimismo, Edzard Ernst nos advierte de que posiblemente debamos abrirnos a lenguas diferentes al inglés que pueden no estar al alcance de todos, como por ejemplo el chino, para eliminar el sesgo de lenguaje. Iniciativas internacionales como Cochrane, que cuentan en sus instituciones autores de muchos países diferentes, sin lugar a dudas fomentan la eliminación de fronteras y sesgos lingüísticos, pudiendo llegar a un mayor número de publicaciones científicas y a una evaluación más exhaustiva de toda la evidencia disponible.
Esperamos que la entrevista realizada a este gran profesional por el que sentimos auténtica admiración, haya  servido para responder, desde el corazón de un apasionado por el rigor científico en temas de salud, a algunas de las incógnitas que suelen aparecer respecto a investigación y evaluación de evidencias en terapias complementarias y alternativas. Por supuesto, alentamos a todos nuestros lectores a que lean periódicamente el blog del Prof. Edzard Ernst, y en especial recomendamos en esta ocasión la entrada Alternative medicine, the baby and the bath water que nos acerca aún más a las preguntas formuladas en esta entrevista sobre las dificultades de investigación en terapias alternativas. En dicha entrada se puede ver cómo una mente privilegiada como la suya e investigador acérrimo, interpreta dichas dificultades para conseguir superarlas en lugar de ningunearlas para alejarse definitivamente de las pruebas científicas más duras que se le puedan y deban realizar a todas las terapias, sean del tipo que sean, para ganarse la credibilidad de la comunidad científica. Asimismo, animamos a nuestros lectores a que lean cualquiera de sus libros, pero en especial su nuevo libro A Scientist in Wonderland: A Memoir of Searching for Truth and Finding Trouble (2015).
servido para responder, desde el corazón de un apasionado por el rigor científico en temas de salud, a algunas de las incógnitas que suelen aparecer respecto a investigación y evaluación de evidencias en terapias complementarias y alternativas. Por supuesto, alentamos a todos nuestros lectores a que lean periódicamente el blog del Prof. Edzard Ernst, y en especial recomendamos en esta ocasión la entrada Alternative medicine, the baby and the bath water que nos acerca aún más a las preguntas formuladas en esta entrevista sobre las dificultades de investigación en terapias alternativas. En dicha entrada se puede ver cómo una mente privilegiada como la suya e investigador acérrimo, interpreta dichas dificultades para conseguir superarlas en lugar de ningunearlas para alejarse definitivamente de las pruebas científicas más duras que se le puedan y deban realizar a todas las terapias, sean del tipo que sean, para ganarse la credibilidad de la comunidad científica. Asimismo, animamos a nuestros lectores a que lean cualquiera de sus libros, pero en especial su nuevo libro A Scientist in Wonderland: A Memoir of Searching for Truth and Finding Trouble (2015).
Equipo redactor de la entrevista: Eduard Baladia (@EBaladia), Rodrigo Martínez-Rodríguez, Julio Basulto (@JulioBasulto_DN)